生物制藥巨頭新基(Celgene)與Acceleron制藥公司近日聯(lián)合宣布,已向美國(guó)食品和藥物管理局(FDA)提交實(shí)驗(yàn)性紅細(xì)胞成熟劑luspatercept治療輸血依賴性β地中海貧血和骨髓增生異常綜合癥(MDS)的生物制品許可申請(qǐng)(BLA)。該BLA申請(qǐng)批準(zhǔn)luspatercept用于:(1)治療與極低危至中危MDS(骨髓涂片存在環(huán)形鐵幼粒細(xì)胞[ring sideroblast,RS])相關(guān)并且需要紅細(xì)胞輸注的貧血成人患者;(2)治療與β地中海貧血相關(guān)并且需要定期輸注紅細(xì)胞的貧血成人患者。
該BLA的提交,基于2項(xiàng)III期臨床研究的數(shù)據(jù),其中:BELIEVE研究在輸血依賴性β地中海貧血患者中開展,MEDALIST研究在極低至中位MDS患者中開展。這2項(xiàng)研究均達(dá)到了主要終點(diǎn)和全部關(guān)鍵次要終點(diǎn)。結(jié)果顯示,與安慰劑組相比,luspatercept治療組患者輸血負(fù)擔(dān)顯著減少。這2項(xiàng)研究的數(shù)據(jù)已在2018年美國(guó)血液學(xué)會(huì)(ASH)年會(huì)上公布。
luspatercept由新基與Acceleron制藥公司合作進(jìn)行全球開發(fā)。根據(jù)上述2項(xiàng)研究的數(shù)據(jù),新基和Acceleron也計(jì)劃在2019年上半年向歐盟提交監(jiān)管文件。
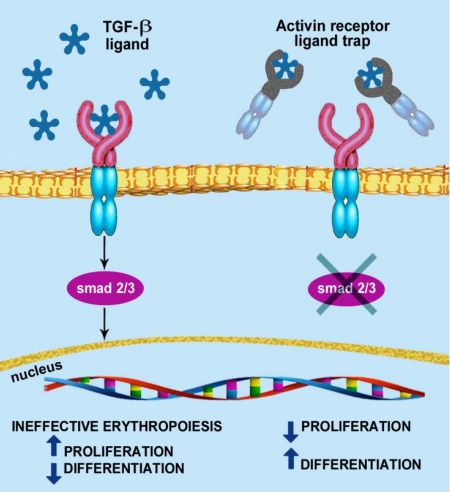
uspatercept是一種首創(chuàng)的(first-in-class)紅細(xì)胞成熟劑(EMA),可調(diào)節(jié)晚期紅細(xì)胞的成熟。該藥是一種可溶性融合蛋白,由人IgG1的Fc結(jié)構(gòu)域與激活素IIB型受體(ActRIIB)胞外結(jié)構(gòu)域融合而成,作為一種配體陷阱,通過靶向結(jié)合可調(diào)節(jié)晚期RBC成熟的轉(zhuǎn)化生長(zhǎng)因子(TGF)-β超家族的特定配體,減少Smad2/3信號(hào)通路的激活,改善無(wú)效紅細(xì)胞的生成,促進(jìn)晚期紅細(xì)胞的成熟,提高血紅蛋白水平。
目前,新基和Acceleron也正在評(píng)估luspatercept治療非輸血性β地中海貧血和骨髓纖維化的潛力。業(yè)界對(duì)luspatercept的商業(yè)前景也十分看好。去年底,EvaluatePharma發(fā)布報(bào)告《Vantage 2019 Preview》,盤點(diǎn)了全球20個(gè)最有價(jià)值的研發(fā)項(xiàng)目,luspatercept以31億美元的凈現(xiàn)值(NPV)位列第18位。(來(lái)源:Bioon.com)